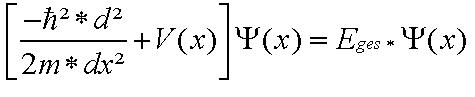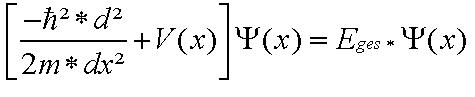Stand
20.01.2024 - Dr. Erhard Henkes
Wechselspiel zwischen Energie
und
Materie
Das Leben basiert auf chemischen Reaktionen
1. Physik liefert die Elementarteilchen für die Chemie
"Die kleinste Einheit ist ein Atom." Das lernte man in der Schule, als
man bereits wusste, dass Atome aus Protonen, Neutronen und Elektronen
bestehen.
In meiner Schulzeit (ca. 1970) informierte man uns über diese
Kernbausteine und die sie umgebende Elektronenhülle. Man erzählte uns
allerdings nichts über die Quarks, die
damals schon bekannt waren. In
der Schule bleibt man gerne hinter dem Fortschritt der
Naturwissenschaften zurück, um die Schüler nicht zu
verwirren.
Chemie ist vor allem eine empirische Wissenschaft. Die Chemiker sind
weit davon entfernt, beliebige chemische Reaktionen gezielt berechnen
zu können. Hat der
Chemiker ein Zielmolekül vor Augen, so führt er aufgrund von bekannten
Reaktionsmechanismen eine Vielzahl von Experimenten durch, um zu
diesem Wunschmolekül zu gelangen. Vielleicht schafft er es nie oder nur
in geringer Ausbeute. Es gibt momentan noch keine allgemein anwendbare
Formel, die den optimalen Weg von den Edukten zu den Produkten vorher
sagt.
Das ist allerdings nicht verwunderlich. Selbst beim Schachspiel, bei
dem nur
wenige Figuren auf einem überschaubaren Brett mit lediglich 8 * 8 = 64
Feldern stehen und
sämtliche Regeln
exakt festgelegt und daher umfassend bekannt sind, gibt es keine Formel
zur Berechnung des besten
Zuges in einer vorgegebenen Position. Selbst für den ersten Zug von
Weiß
gibt es nicht den besten Zug!
Gleichzeitig suchen die Physiker die Weltformel,
Chemiker die
theoretische Berechnung von
Reaktionspfaden, Schachcomputerexperten die Formel für den besten
Schachzug. In der Biochemie
steht man staunend noch weitgehend am Anfang. Für engagierte Forscher
gibt es
somit sowohl in der Theorie als auch in der Praxis noch viel zu
entdecken. Mit dieser Mischung aus Bescheidenheit und Neugier
sollte man sich den Naturwissenschaften nähern.
2. Materie besteht vorwiegend aus leerem Raum und Energie
Zum Verständnis von Materie muss man
sich zunächst von makroskopischen Begriffen lösen und sich geistig in
das
Innere der Materie hinein versetzen. Nehmen wir ein Eisengewicht mit
einer
Masse von 1 kg in die Hand, so haben wir durch die relativ hohe Dichte (7,9
g/cm³) das Gefühl, einen sehr kompakten
und einheitlich aufgebauten Gegenstand in Händen zu halten. Eisen ist
mit dieser Dichte ein Schwermetall im
Gegensatz zu
Leichtmetallen.
Die willkürliche Trennlinie wird per Definition im
Dichtebereich von 4,5 bis 5,0 g/cm³
gezogen.
Eisen ist ein wichtiges Element für Lebewesen. Man findet es in den
roten Blutkörperchen.
Als Zentralatom im Hämoglobin
und Myoglobin
ist es in der Lage Sauerstoff, der z.B. bei Menschen in der Lunge
angeboten wird, als Ligand so anzulagern, dass dieser nach dem
Transport zu den Zellen wieder leicht abgegeben werden kann. Eisen ist
weiterhin Bestandteil in verschiedenen Enzymen.
Wie sieht
die uns bisher bekannte Wirklichkeit aus? Was wissen wir über 1 kg
Eisen?
Eisen besteht aus Eisenatomen, also nicht aus Molekülen. Moleküle
bestehen aus zwei oder mehr Atomen, die durch ausreichend starke
Bindungskräfte miteinander in Verbindung bleiben. Die geometrische
Anordnung der Atome des Eisens
liegt im Festkörper in folgenden Modifikationen vor:
alpha-Eisen: kubisch-raumzentriert (bcc)
bis 911°C stabil,
gamma-Eisen:
kubisch-flächenzentriert (fcc) bis 1401°C
stabil,
delta-Eisen:
kubisch-raumzentriert
(bcc) bis
1535°C (Schmelzpunkt).
Mit der kubisch-raumzentrierten (bcc) Packung bei
Raumtemperatur ist eine Raumerfüllung mit Eisenatomen von 68 %
gegeben.
Mit der kubisch-flächenzentrierten (fcc) Packung bei
911-1401°C ist eine Raumerfüllung mit Eisenatomen von 74 %
gegeben.
Bis zum Curiepunkt (760 °C) ist Eisen magnetisch.
Die nicht magnetische Modifikation zwischen 760 °C und 911 °C wird
daher auch β-Eisen genannt.
Wieviele
Eisenatome benötigt man für 1 kg Eisen?
Die Atommasse beträgt 55,845 g/mol. Also rechnen wir 1000 g / 55,845
g/mol
= 17,907 mol.
Nun müssen wir nur noch wissen, wieviele Teilchen ein Mol bilden?
Ein Mol ist die
Stoffmenge eines
Systems, das aus ebensoviel Einzelteilchen besteht, wie Atome in 12
Gramm des Kohlenstoffnuklids 12C enthalten sind.
Dieser Zahlenwert heißt
Avogadro-Konstante: ca. 6,022 · 1023
(Teilchen/mol).
Nun können wir die Zahl der Atome in 1 kg
Eisen berechnen: 17,907 mol *
6,022*1023 Teilchen/mol = 1,078
* 1025 Teilchen.
Eine hohe Zahl an einzelnen Atomen.
Wie groß ist denn so ein Eisenatom?
Der Atomradius des Eisens liegt bei ca. 0,14 nm.
Wie stellt man sich nun so ein Atom
vor?
Als metallisch glänzende
winzige kompakte Kugel? Wenn das so wäre, würde unser 1kg-Eisengewicht
vor uns zerfließen und einen riesigen See von Eisenatomkügelchen mit
einem Durchmesser von unter 1 nm bilden. Wir wissen, dass man selbst
mit einem Hammer diesen Eisenblock nicht auseinander schlagen kann. Um
Eisen zu trennen, bedarf es einer guten Säge und viel Kraft. Zur
Verformung benötigt man Hitze und Kraft. Eisenatome halten folglich
gut zusammen.
Die metallischen Eigenschaften sind eine makroskopische
Eigenschaft und helfen uns beim Verständnis des Eisenatoms nicht
wirklich weiter. Gehen wir eine Ebene tiefer. Wir wissen seit etwa
einem Jahrhundert, dass Atomkerne aus Protonen
und Neutronen bestehen. Der Kern ist von Elektronen umgeben. Die Zahl
der Elektronen ist beim neutralen Atom
identisch mit der Zahl der Protonen. Protonen tragen jeweils eine
positive Elementarladung und Elektronen jeweils eine negative
Elementarladung.
Wie viele Elektronen, Protonen und
Neutronen hat ein Eisenatom?
Ein Eisenatom verfügt über 26 Elektronen und besitzt wegen der
Ladungsneutralität somit auch 26 Protonen.
Diese Zahl 26 nennt man
auch Ordnungszahl oder Kernladungszahl des Elementes.
Wieviele Neutronen hat ein Eisenatom?
Diese Zahl schwankt beim normalen Eisen zwischen 28, 30, 31 und 32. Man
hat hier nämlich ein Gemisch folgender "Isotope" vorliegen:
5,80%
54Fe (28 Neutronen)
91,72%
56Fe (30 Neutronen)
2,20%
57Fe (31 Neutronen)
0,28%
58Fe (32 Neutronen)
Das erklärt, warum das Molgewicht niedriger als 56 g/mol - nämlich
55,845 g/mol - ist.
Chemisch reagieren diese Eisen-Isotope gleich, da die
Elektronenkonfiguration identisch ist. Die Zahl der Neutronen
bestimmt das kernphysikalische Verhalten, nicht das in der Chemie
beobachtete Verhalten der
Elektronenhülle.
Schauen wir uns nun das häufigste Eisenatom, nämlich 56Fe,
genau an. Fassen wir noch einmal zusammen: 26 Protonen, 30 Neutronen,
26 Elektronen.
Zum Vergleich: Man geht davon aus, dass das uns bekannte Universum etwa
1080
Protonen enthält.
Wir beschaffen uns zunächst die bekannten physikalischen Daten dieser
"Elementarteilchen":
Ruhemasse
Radius
Ladung Quarks
Proton
1,6726*10-27 kg ca. 10-15
m
1e uud
Neutron
1,6749*10-27 kg
ca.
10-15
m
keine udd
Elektron
9,1094*10-31
kg
ca. 10-19
m
-1e "Elementarteilchen"
Zum Vergleich: Der Atomradius von Eisen liegt bei ca. 1,4⋅10-10
m.
Mit diesen Größenordnungen der Radien wird der Aufbau des Eisenatoms
klarer:
In der Mitte befindet sich der Atomkern mit einer Größenordnung von 10-14
bis 10-13 m. Der Kern ist also etwa 10000 bis 1000 mal
kleiner als
das gesamte Atom. Zwischen Kern und Außenhülle herrscht eine
ausgedehnte "Leere".
Irgendwo in diesem aus Sicht des Elektrons riesigen Atoms existieren 26
"als Partikel gesehen" (das ist nur eine leicht vorstellbare Sicht,
besser ist die Sicht als elektromagnetische Welle) winzige Elektronen,
die im Vergleich zum gesamten
Atom etwa um den Faktor eine Milliarde kleiner sind.
In seinem berühmten Streuversuch
entdeckte
Ernest Rutherford durch Beschuss von Goldfolie mit alpha-Teilchen (
Helium-Atomkern, 4He2+ ) im Jahr 1911 aufgrund
der geringen Ablenkungsrate, dass die Atome zum größten
Teil aus Nichts - also freiem Raum - bestehen und die Materie in sehr
kleinen Kernen
konzentriert ist.
Fazit:
Materie besteht überwiegend aus
"leerem" Raum!
Sind Protonen und
Neutronen elementare Teilchen?
Nein! Während Elektronen zur Zeit als elementare Teilchen gelten,
stellt man sich
Protonen und Neutronen aufgebaut aus Quarks vor. Ein Proton wird im
Quark-Modell
aus
zwei Up-Quarks und einem Down-Quark gebildet. Zählt man die bekannte
Masse der drei
Quarks zusammen, erkennt man, dass sie nur etwa 20% der Masse des
Protons liefern. Die quantitative Beschreibung liefert die
Relativitätstheorie, nach
der für Masse und Energie die berühmte Gleichung
E = mc2
gilt. Der überwiegende Teil der Masse des Protons stammt somit nicht
aus
der Masse seiner elementaren Teilchen, sondern entspringt der Energie
der
Bindung
zwischen ihnen! Versucht man Quarks zu isolieren, so gelingt dies unter
den eingesetzten Laborbedingungen nicht. Energie ist wahrscheinlich das
"Elementarste" und die verschiedenen Teilchen wie Quarks, Elektronen,
deren Antiteilchen und "Bindungsenergie" bzw. Austauschteilchen wären
dann nur eine "materielle" Erscheinungsform von Energie.
Solange es keine gesicherte "Grand
Unification Theory" (elektromagnetische, starke und schwache
Wechselwirkung) oder gar "Theory of
Everything" (inclusive Gravitation) gibt, kann man nur auf das
derzeitige Standardmodell der
Elementarteilchen verweisen, das jedoch ebenfalls nicht völlig
abgesichert und verstanden ist.
Warum werden die positiv geladenen
Protonen im Atomkern
nicht durch Coulomb-Kraft (elektrische
Ladung) voneinander
abgestoßen?
Die starke Kernkraft - eine der
vier
Grundkräfte - wirkt nur
auf Quarks
und Teilchen,
die aus Quarks aufgebaut sind, d.h.
Mesonen und
Baryonen.
Diese Teilchen werden auch unter dem Begriff
Hadronen
zusammengefasst. Hadronen sind stark gebundene Objekte. Nach außen ist
wenig von ihren "Farbladungen"
zu bemerken. In diesem Sinne ähneln sie
einem
Atom,
das nach außen elektrisch neutral erscheint.
Bringt man zwei Baryonen nahe zusammen, so greift eine
"Restwechselwirkung" der starken Kernkraft, die wesentlich schwächer
ist
als die direkte starke Kernkraft aber stärker als die elektrische
Abstoßung zwischen Protonen. Auf diese Weise bewirkt diese Kraft den
Zusammenhalt der
Protonen und Neutronen im Atomkern.
3. Elementumwandlungen gehören zur Physik nicht zur Chemie
Der große Traum der Alchimisten war es, Gold durch Umwandlung aus
anderen Elementen herzustellen. Es konnte nicht gelingen, denn chemisch
ist dies nicht möglich. Chemie spielt sich in der Elektronenhülle und
nicht im Atomkern ab. Veränderungen der Atomkerne gehören zum Bereich
der Physik. Auf diesem Wege kann man Elemente ineinander umwandeln. Ein
prominentes Beispiel ist der radioaktive Zerfall von Uran über Radium
zu Blei:
siehe:
https://de.wikipedia.org/wiki/Uran-Radium-Reihe
... und die Kernreaktionenen in der Sonne:
PP-Zyklus:
https://de.wikipedia.org/wiki/Proton-Proton-Reaktion
... und CNO-Zyklus:
https://de.wikipedia.org/wiki/Bethe-Weizs%C3%A4cker-Zyklus
Hierbei entstehen aus Wasserstoffkernen schwerere Elemente wie
Helium, Kohlenstoff, Stickstoff und Sauerstoff.
4. Elektronen - die Basis für chemische Reaktionen
Die Masse des Elektrons
beträgt etwa 1/1836 der Masse des Protons. Die
gesamte Masse des Atoms ist damit auf einen winzigen Punkt, nämlich den
Atomkern, konzentriert. Die Bindung der Elektronen an ihren "leeren
Raum" um den Atomkern herum
erfolgt durch elektrische Anziehung zwischen positiv geladenen Protonen
und
negativ geladenen Elektronen.
Was sind Elektronen, wie verteilen
sich diese im Eisenatom?
Bezüglich der "Elektronenkonfiguration" gibt es verschiedene Theorien.
Die Atomorbitaltheorie sieht das Elektron als
elektromagnetische Welle und nicht als kleines Teilchen. Man
unterscheidet hierbei verschiedene
Orbitale und damit
verbundene Energiezustände, die mit Elektronen
besetzt werden können.
Beim Eisenatom kann man die Verteilung der Elektronen wie folgt in
Kurzform
aufschreiben: 1s2
2s2
2p6 3s2 3p6 3d6 4s2.
Die hoch gestellten Zahlen sind die Anzahl der Elektronen in den
jeweiligen Orbitalen und ergeben zusammen 26 Elektronen.
Die Chemie eines Atoms wird durch die Elektronenkonfiguration bestimmt.
Daher sollte man zunächst alles über das Elektron in Atomen
und Molekülen wissen, was die moderne Physik zu bieten hat.
Elektronen sind Leptonen,
besitzen einen Spin
von ±1/2.
Elementarteilchen mit solchem Spin gehören zur Klasse der Fermionen.
Das Positron
ist das entsprechende Antiteilchen. Das
Elektron hat eine elektrische
Ladung, die man als "Elementarladung" bezeichnet (freie Teilchen
sind
neutral oder besitzen ein ganzzahliges Vielfaches der Elementarladung.
Die Ladung der Quarks beträgt interessanterweise ein ganzzahliges
Vielfaches eines Drittels der Elementarladung).
Das Elektron wird in der Physik als Welle
gesehen, aber auch als Teilchen.
Man spricht hier in der modernen Physik vom Welle-Teilchen-Dualismus.
Einen Fortschritt in der Betrachtung des Elektrons im Atom brachte die Quantenmechanik.
Quantenmechanik und Allgemeine Relativitätstheorie stehen jedoch noch
im Widerspruch bezüglich eines Teilchens in der Nähe eines Schwarzen
Lochs (Singularität). Gemäß der Allgemeine Relativitätstheorie wird ein
solches Teilchen in einen Zustand unendlicher Dichte gequetscht. Gemäß
der Quantenmechanik wird das Partikel eine Unsicherheit in der Position
behalten. Somit kann es die Singularität nicht erreichen und damit dem
totalen Kollaps (unendliche Dichte) entkommen. Dieser Gegensatz
entsteht durch die Wirkung extrem hoher Gravitationskräfte. Hier haben
Physiker im Rahmen der Vereinheitlichung noch eine harte Nuss zu
knacken.
Mit dem Ansatz einer Wellenfunktion für das "freie Elektron" gelangt
man (unter Elimierung
der Zeit) zur grundlegenden Gleichung
für die theoretische Chemie, nämlich der stationären Schrödingergleichung
(hier die Darstellung in Abhängigkeit der x-Achse).
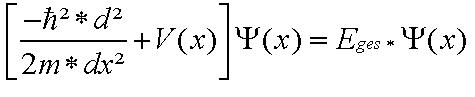
Um die Herleitung und Bedeutung dieser berühmten und wichtigen
Gleichung zu verstehen,
sollte man folgende physikalischen Zusammenhänge nutzen, die durch
Kombination klassischer Mechanik und Welle-Teilchen-Dualismus möglich
sind:
Gesamtenergie
= kinetische Energie + potenzielle Energie
Eges = Ekin + Epot
= Ekin
+ V
Kinetische Energie
Ekin
= p2 /
2m
Impuls
p = mv
Planck/Einstein/de Broglie (Wellen-Teilchen-Dualismus):
Ekin = hf = pc
c2 = 1 / ( p2 /
Ekin2 )
= 1 / ( 2m (Eges-V)
/ (hf)2 )
Setzt man diese Zusammenhänge in die
allgemeine Wellengleichung ein, so erhält man zunächst die ort- und zeitabhängige
Schrödingergleichung, die man dann in die zeitunabhängige, d.h.
stationäre, Schrödingergleichung umwandelt.
Das Quadrat des Betrages dieser "Wellenfunktion" |ψ(x)|2 versteht man als
"Wahrscheinlichkeitsdichte" des "Teilchens", das als Welle beschrieben
wird, hier das Elektron. Dieser Ansatz führt zu den
Atomorbitalen, die
diese Wahrscheinlichkeitsdichte für den Betrachter räumlich
visualisieren.
Bis hierher haben wir das Teilchen als stationäre Welle beschrieben.
Entscheidend ist nun das Verständnis für die räumliche Verteilung und
die Quantisierung der erlaubten Energiezustände. Am
besten kann man dies am berühmten Beispiel des "eindimensionalen
Potenzialkastens" verstehen. Ein Teilchen, z.B. unser Elektron, darf
sich nur entlang einer x-Achse zwischen zwei Wänden mit unendlich hoher
potenzieller Energie bewegen. Die Frage ist nun, wo sich das Teilchen
befindet und wie sein energetischer Zustand bei Zuführung bzw. Abgabe
von Energie ist.
Hierbei ergeben sich durch Lösung der Schrödingergleichung mit diesen
Randbedingungen folgende
Zusammenhänge, die alle im Gegensatz zur klassischen Mechanik stehen:
1)
Die
Aufenthaltswahrscheinlichkeit ist nicht
gleichverteilt.
2) Nicht alle Energiezustände sind
erlaubt, sondern nur bestimmte "quantisierte" Energieniveaus.
3) Der Grundzustand ist stabil, denn das Teilchen kann keine weitere
Energie abgeben. |
Ist das Potenzial der Wände nicht unendlich, sondern endlich, so ergibt
sich der sehr interessante "Tunneleffekt",
der eine Aufenthaltswahrscheinlichkeit des "Teilchens" auch außerhalb
der Barriere beschreibt.
Ein typisches
Anwendungsbeispiel ist das Rastertunnelmikroskop.
Das "Teilchen" als Welle, die Quantisierung "erlaubter" Energieniveaus
und der Tunneleffekt sind wesentliche Fundamente im Verständnis des
Atomaufbaus.
In der theoretischen Chemie verwendet man das Orbitalmodell
zum Verständnis von Atomen und Molekülen seit vielen Jahren ziemlich
erfolgreich.
Die nachfolgende Abbildung zeigt das s-, die drei p- und die fünf
d-Orbitale:
siehe:
http://www.chemieseite.de/allgemein/ao.png
Hier wird der "Vielteilchenzustand" der Elektronen der untersuchten
Atome einfach als Summe der "Einteilchenzustände" der Elektronen
betrachtet. Das Modell vernachlässigt
die gegenseitige
Coulomb-Abstossung der Elektronen und die Wechselwirkung der Bewegungen
der Elektronen bezüglich der Bewegung des Atomkerns. Man erhält
dennoch
eine weitgehend korrekte Beschreibung der Energieniveaus des Atoms.
Dieses vereinfachte Modell liefert dem Chemiker Quantenzahlen
und "Orbitale" als räumliches Modell für die "Elektronenverteilung".
Einfache Merkregeln wie Elektronenkonfigurationen,
Hund'sche Regeln,
Oktettregel
und magische Zahlen
werden durch dieses quantenmechanische Modell untermauert.
Durch
einfache Linearkombination mehrerer Atom-Orbitale erhält man Molekülorbitale.
Die MO-Theorie
erklärt reale Zustände sehr gut. Nehmen wir das
Sauerstoffmolekül als
erfolgreiches Beispiel:
Die zwölf (zwei mal sechs) Valenzelektronen des Sauerstoffmoleküls
verteilen sich auf vier bindende (σs, σx, πy,
und πz) und drei antibindende Molekülorbitale (σs*,
πy*, πz*). Dies erklärt den
Bindungsabstand von 121 pm und die Bindungsenergie von 498 kJ/mol
besser als das klassische Modell mit der "Doppelbindung". Zusätzlich
versteht man mit dieser Theorie den beobachteten Paramagnetismus und
die radikalischen Reaktionen des Sauerstoffmoleküls, denn nun findet
man zwei
ungepaarte Elektronen in den antibindenden pi-Molekülorbitalen.
Einen eindrucksvollen Versuch
zum Thema Paramagnetismus von flüssigem Sauerstoff findet man in diesem
Video.
Die Bindung der Elektronen an Atome oder Moleküle ist unterschiedlich
stark ausgeprägt. Eine wichtige Kennzahl bei Atomen ist die sogenannte "Elektronegativität",
die im Periodensystem der Elemente wegen ihrer Bedeutung typischerweise
aufgeführt wird. Das elektronegativste Element ist Fluor, dessen Atome
ein Elektron begierig zur Erreichung des Elektronen-Oktetts aufnehmen.
Auf der Gegenseite steht Cäsium, das als Alkalimetall sein einsames
Elektron gerne abgeben möchte, um ein Elektronen-Oktett zu bilden.
Ein
überzeugendes Experiment ist die
Reaktion
von Alkalimetallen mit
Wasser.
Je geringer die Elektronegativität, desto
heftiger findet die nachfolgende Reaktion unter Bildung von gasförmigem
Wasserstoff statt:
M
--> e- + M+
H2O
+ e-
--> HO- + 1/2
H2
5. Pauli-Prinzip, Hundsche Regel und Periodensystem
Das Orbitalmodell verleiht einem Elektron vier Quantenzahlen:
- "Schale" des Elektrons (Hauptquantenzahl)
- "Unterschale" des Elektrons
(Nebenquantenzahl)
- "Spin" des Elektrons (Spinquantenzahl)
- Magnetische Quantenzahl
Den Aufbau des Periodensystems versteht man, wenn man das Orbitalmodell
und folgende Regeln kennt:
5.1. Pauli-Prinzip
Das Pauli-Prinzip
gilt streng für Fermionen (Teilchen
mit halbzahligem Spin), allerdings nicht für Bosonen, und lautet:
Ein Atom darf keine Elektronen enthalten, die in allen vier
Quantenzahlen übereinstimmen.
Ein
Elektronenorbital darf daher nur von maximal zwei Elektronen mit
unterschiedlichem Spin besetzt sein.
In der Astronomie wird durch das Pauli-Prinzip erklärt, dass alte
Sterne, wie zum Beispiel weiße Zwerge oder Neutronensterne,
nicht unter ihrer eigenen Gravitation zusammenbrechen.
Hierbei erzeugen
die Fermionen einen Gegendruck, der einer weiteren Kontraktion
entgegenwirkt.
5.2. Hundsche Regeln
In der Chemie wird von den vier Hundschen
Regeln, vor allem folgende Regel genannt:
Wenn für die Elektronen eines Atoms mehrere Orbitale mit gleichem
Energieniveau zur Verfügung stehen, werden diese zuerst mit je einem
Elektron mit parallelem Spin
besetzt. Anschließend werden sie durch ein zweites
Elektron (mit unterschiedlicher Spinquantenzahl) aufgefüllt.
Zu
dieser Regel gibt es allerdings Ausnahmen (in den Nebengruppen).
5.3. Periodensystem der Elemente
Das sogenannte Periodensystem stellt die "Ordnung" der chemischen
Elemente
vereinfacht
für s-, p- und d- und f-Orbitale dar.
Es gibt daneben ein "erweitertes
Periodensystem", das s-, p-, d-, f- und g-Orbitale und damit auch
Elemente jenseits der Kernladungszahl 118, nämlich bis 218, umfasst.
Wer sich dafür interessiert, wie f- und g-Orbitale räumlich aussehen,
sei auf folgende Seite mit
Atomorbitalen
verweisen.
6. Moleküle - die verschiedenen Bindungsarten
Eines der wirklich schwierigen Themen ist die Bindung zwischen Atomen.
Die MO-Theorie hat hier unsere Vorstellungen verfeinert, aber man
unterscheidet auch heute noch grob in folgende Kategorien:
6.1. Kovalente Bindung:
Bei der vereinzelten Verbindung (keine "Gitter") von Nichtmetallen
untereinander entstehen einzelne Moleküle. Die Atome teilen sich
Elektronen, um den besonders stabilen "Edelgaszustand"
anzustreben. Ein
typisches Beispiel ist molekularer Wasserstoff. Verbinden sich zwei
Wasserstoffatome, so wird durch Bildung des Wasserstoffmoleküls eine
Energiemenge von ca. 436 kJ/mol frei.
6.2. Ionenbindung:
Die elektropositiven Atome geben ihre Außenelektronen an die
elektronegativen Atome ab. Positive und negative Ionen bilden ein
Kristallgitter. Natriumchlorid ("Kochsalz") ist der typische
Vertreter dieser Gruppe. Die klassische Verbindung zwischen Metallen
und Nichtmetallen. Die frei gesetzte Energiemenge bei der Verbindung
von Natrium und Chlor liegt in der gleichen Größenordnung, die
angebebenen Daten hängen stark von den Randbedingungen ab.
6.3. Metallbindung:
Die Atome trennen sich von ihren Außenelektronen und formen ein
sogenanntes "Metallgitter". Innerhalb dieses
Gitters sind die freien Elektronen gut beweglich. Dies führt zu
den metallischen Eigenschaften wie Wärme- und Elektro-Leitfähigkeit.
Gold ist wohl das beliebteste Metall. Bezüglich der "entarteten"
Elektronen spricht man aufgrund der
Mobilität von "Elektronengas"
oder "Fermigas".
6.4. Ligandbindung:
Ein Ligand bindet sich hierbei koordinativ an ein Zentralatom. Die
Bindungselektronen stammen hierbei nur vom Liganden. Das Zentralatom -
meist ein Metallion - weist dabei in seiner Elektronenkonfiguration
Lücken auf. Die theoretische Beschreibung erfolgt durch die Ligandenfeldtheorie.
Ein bekanntes Beispiel ist der eisenhaltige rote Blutfarbstoff
und Sauerstoff-Carrier Hämoglobin. Es
gibt neben Eisen noch andere Zentralatome in biologischen
sauerstoffbindenden Komplexen, zum Beispiel Kupfer, Mangan und
Vanadium.
7. Biochemie
Physik und Chemie helfen uns die wissenschaftlichen Grundlagen für das
Leben auf der Erde zu verstehen. Hierbei findet man eine Komplexität,
die immer wieder die Frage nach ihrer Entstehung aufwirft. Man geht
davon aus, dass das erste Leben
auf der Erde
vor ca. 3,8 Mrd. Jahren entweder von außen eingetragen wurde oder sich
aus anorganischer über den Weg
zu organischer Materie entwickelt hat. Die Suche nach "LUCA"
(Last Universal Common Ancestor),
unserem Urvorfahr, ist noch in
vollem Gange.
Einen sehr guten Überblick über den Stammbaum des Lebens bietet diese
Seite.
7.1. Energie, Kohlenstoffkreislauf und
Atmung
Die wesentlich beteiligten - allesamt nichtmetallischen - Atome sind "S
C H O P N".
Die Chemie des Lebens, die man in heutiger Zeit vorfindet,
betrachten wir nachstehend vor allem unter den Aspekten
Wasser findet sich auf der Erde in allen drei Aggregationszuständen
(Eis, flüssiges Wasser, Wasserdampf) und stellt zusammen mit der
oxidierten Form, nämlich Sauerstoff, eine wesentliche Grundlage für die
Biochemie dar. Bedingt durch die hohe Polarität (polares
Lösungsmittel, Wasserstoffbrückenbindungen) und seine
Dichteanomalie (höchste Dichte bei +4°C, damit kein Durchfrieren
von Teichen und Seen) ist Wasser wirklich ein "Quell" des Lebens.
Gasförmiges Kohlendioxid (CO2) ist ein ubiquitärer Lieferant
für die
notwendigen Kohlenstoffatome. Hieraus entwickeln Lebewesen Glucose C6H12O6
und Stärke (C6H10O5)n,
die ideal als chemische Energiespeicher dienen. Glucose wird über
Pyruvat wiederum zu Kohlendioxid "veratmet". Dies führt zum
Kohlenstoffkreislauf.
7.2. Lebensenergie von der Sonne wird
durch Photosynthese eingefangen
Die ursprüngliche Lebensenergie kommt von der Sonne in Form von Strahlung.
Dieser Zentralstern unseres Planetensystems liegt ca. 150.000.000 km
von uns entfernt und seine durch Kernfusion (s.o.) erzeugte
Strahlungsenergie treibt das Leben an. Die auf die Erde eingestrahlte
Energie schwankt jahreszeitlich bedingt zwischen 1,32 und 1,42 Kilowatt
pro Quadratmeter.
Durch Photosynthese
in den Chloroplasten
wird das durch seine gasförmige Ausbreitung leicht zur Verfügung
stehende Kohlendioxid in die Kohlenhydrate Glucose und Stärke
umgewandelt.
Die Photosynthese umfasst drei wesentliche Abschnitte:
1) Lichtenergie wird durch Farbstoffe (Chlorophyll,
Carotinoid,
Bacteriorhodopsin, Phycobilin)
aufgenommen.
2) Die absorbierte Energie wird in chemische Energie umgewandelt.
3) Diese chemische Energie wird zur Synthese
energiereicher organischer Verbindungen eingesetzt.
Als Reduktionsmittel für das Kohlendioxid
können prinzipiell verschiedene wasserstoffhaltige
Reduktionsmittel wie Wasser (H2O), Wasserstoff
(H2), Schwefelwasserstoff (H2S)
und sogar organische Moleküle wie Acetat
oder Ethanol
eingestzt werden. Algen
und fast alle Landpflanzen verwenden ausschließlich Wasser (H2O)
als Reduktionsmittel. Durch Oxidation von Wasser entsteht der für uns
Menschen lebenswichtige Sauerstoff (oxygene
Photosynthese).
Im Zytoplasma
und in den Mitochondrien
wird Glucose, die gleichzeitig als Kohlenstoff- und chemischer
Energiespeicher
fungiert, in mehreren Schritten zurück zu Kohlendioxid und Wasser
umgesetzt. Hierbei wird ein wesentlicher "Treibstoff" des Lebens,
nämlich Adenosintriphosphat
(ATP) aus Adenosindiphosphat
(ADP) und Phosphat gebildet. Besonders interessant ist die Gewinnung
des Wasserstoffs in Form von NADH/H+ im Citrat-Zyklus
und die schrittweise Verwendung dieser Reduktionsäquivalente in der
Atmungskette unter Gewinnung von ATP.
Beim Glucose-Abbau findet man bei Eukaryonten folgende vier Schritte:
1) Die Glykolyse
verläuft im Zytoplasma und liefert Pyruvat.
2) Pyruvat wird unter Abspaltung von CO2 zu Acetyl-CoA (Coenzym
A; eine andere Quelle des Acetyl-CoA ist übrigens der Fettsäure- oder
Aminosäureabbau) umgesetzt. Dieser Schritt findet in der Matrix des
Mitochondriums statt.
3) Im
Citrat-Zyklus wird weiteres CO2 abgespalten. Der Wasserstoff
des
Pyruvats wird in das Reduktionsmittel NADH/H+ umgewandelt.
Dies findet in der Matrix des Mitochondriums statt.
4) Der letzte Schritt verläuft in der inneren Membran des
Mitochondriums durch Verwertung
des NADH/H+ unter Oxidation mit Sauerstoff (Atmungskette).
Wer denkt, dass die Photosynthese nur bei Pflanzen vorkommt, dem sei
das Studium der interessanten Meeresschnecke
Elysia
chlorotica empfohlen. Diese Schnecke frisst in ihrer Jugend grüne
Algen und baut die
Farbstoffe in ihre eigenen Zellen ein, um Photosynthese zu betreiben
und auf diese Weise auch ohne organische Nahrung - also nur durch die
Energie des Lichtes - zu überleben. Es handelt sich hierbei
übrigens auch um einen horizontalen Gentransfer von einer Pflanze auf
ein Tier. Die Pflanzeneigenschaften können allerdings noch nicht
vererbt werden, sondern jede Schnecke muss sich diese erneut
"anfressen".
7.3. Pyruvat als Endprodukt der
Glykolyse und Kreuzungspunkt wichtiger "biochemical pathways"
Die Glykolyse als erster Schritt in der Verwertung der in der Glucose
gespeicherten Energie ist ein evolutionär sehr alter "biochemical
pathway", der vermutlich seit 3,5 Milliarden Jahren den
Stoffwechsel auf der Erde universell prägt und sich bereits bei den
ersten Prokaryoten fand. Die Glykolyse spaltet ein Molekül Glucose in
zwei Moleküle Pyruvat und Wasser. Energetisch werden hierbei in Summe
zwei Moleküle ATP erzeugt. Energetisch muss man auch die Erzeugung von
NADH/H+ als chemisch gebundener Wasserstoff beachten, denn
dieses biochemische
Reduktionsmittel kann letztendlich mit Sauerstoff unter Energiegewinn
(ATP-Erzeugung) zu Wasser reagieren (siehe Atmungskette).
Glucose + 2 NAD+ + 2
ADP + 2 P --> 2 Pyruvat + 2 NADH/H+ + 2
ATP + 2 H2O
ΔRGo' = - 85 kJ/mol
Eine Übersicht über die Einbettung in die Gesamtprozesse findet man
z.B. hier
und eine Animation hier.
Wichtige Stoffwechselwege "kreuzen" sich an diesem C3-Molekül und
seinem Abbauprodukt Acetyl-CoA:
Siehe Biochemical Pathways: Glykolyse Lactat und
Alanin Acetyl-CoA Fettsäureabbau